
hTX帝国网站管理系统 hTX帝国网站管理系统
hTX帝国网站管理系统
 总缓解率(ORR)达 86%,基石药业递交胃肠道间质瘤精准靶向药avapriti...
总缓解率(ORR)达 86%,基石药业递交胃肠道间质瘤精准靶向药avapriti...
 avapritinib登《柳叶刀》子刊:胃肠道间质瘤(GIST)患者24个月OS率达8...
avapritinib登《柳叶刀》子刊:胃肠道间质瘤(GIST)患者24个月OS率达8...
其他热门专题
 首款4线治疗胃肠道间质瘤治疗新药Ripretinib(Qinlock、瑞普替尼)...
首款4线治疗胃肠道间质瘤治疗新药Ripretinib(Qinlock、瑞普替尼)...
 总缓解率(ORR)达 86%,基石药业递交胃肠道间质瘤精准靶向药avapriti...
总缓解率(ORR)达 86%,基石药业递交胃肠道间质瘤精准靶向药avapriti...
 avapritinib登《柳叶刀》子刊:胃肠道间质瘤(GIST)患者24个月OS率达8...
avapritinib登《柳叶刀》子刊:胃肠道间质瘤(GIST)患者24个月OS率达8...
其他热门专题
 首款4线治疗胃肠道间质瘤治疗新药Ripretinib(Qinlock、瑞普替尼)...
首款4线治疗胃肠道间质瘤治疗新药Ripretinib(Qinlock、瑞普替尼)...
 总缓解率(ORR)达 86%,基石药业递交胃肠道间质瘤精准靶向药avapriti...
总缓解率(ORR)达 86%,基石药业递交胃肠道间质瘤精准靶向药avapriti...
 avapritinib登《柳叶刀》子刊:胃肠道间质瘤(GIST)患者24个月OS率达8...
avapritinib登《柳叶刀》子刊:胃肠道间质瘤(GIST)患者24个月OS率达8...
其他热门专题
 总缓解率(ORR)达 86%,基石药业递交胃肠道间质瘤精准靶向药avapriti...
总缓解率(ORR)达 86%,基石药业递交胃肠道间质瘤精准靶向药avapriti...
 avapritinib登《柳叶刀》子刊:胃肠道间质瘤(GIST)患者24个月OS率达8...
avapritinib登《柳叶刀》子刊:胃肠道间质瘤(GIST)患者24个月OS率达8...
其他热门专题
 总缓解率(ORR)达 86%,基石药业递交胃肠道间质瘤精准靶向药avapriti...
总缓解率(ORR)达 86%,基石药业递交胃肠道间质瘤精准靶向药avapriti...
 avapritinib登《柳叶刀》子刊:胃肠道间质瘤(GIST)患者24个月OS率达8...
avapritinib登《柳叶刀》子刊:胃肠道间质瘤(GIST)患者24个月OS率达8...
其他热门专题
 首款4线治疗胃肠道间质瘤治疗新药Ripretinib(Qinlock、瑞普替尼)...
首款4线治疗胃肠道间质瘤治疗新药Ripretinib(Qinlock、瑞普替尼)...
 总缓解率(ORR)达 86%,基石药业递交胃肠道间质瘤精准靶向药avapriti...
总缓解率(ORR)达 86%,基石药业递交胃肠道间质瘤精准靶向药avapriti...
 avapritinib登《柳叶刀》子刊:胃肠道间质瘤(GIST)患者24个月OS率达8...
avapritinib登《柳叶刀》子刊:胃肠道间质瘤(GIST)患者24个月OS率达8...
其他热门专题
 胃癌 “去化疗”之路有多远?
胃癌 “去化疗”之路有多远?
 胃癌的化疗及靶向药物治疗,一文整理!
胃癌的化疗及靶向药物治疗,一文整理!
 局部进展期胃癌新辅助药物治疗历史、现状与展望...
局部进展期胃癌新辅助药物治疗历史、现状与展望...
 胃癌的靶向治疗和免疫治疗进展
胃癌的靶向治疗和免疫治疗进展
 一文说清楚胃癌靶向治疗,收藏备用!
一文说清楚胃癌靶向治疗,收藏备用!
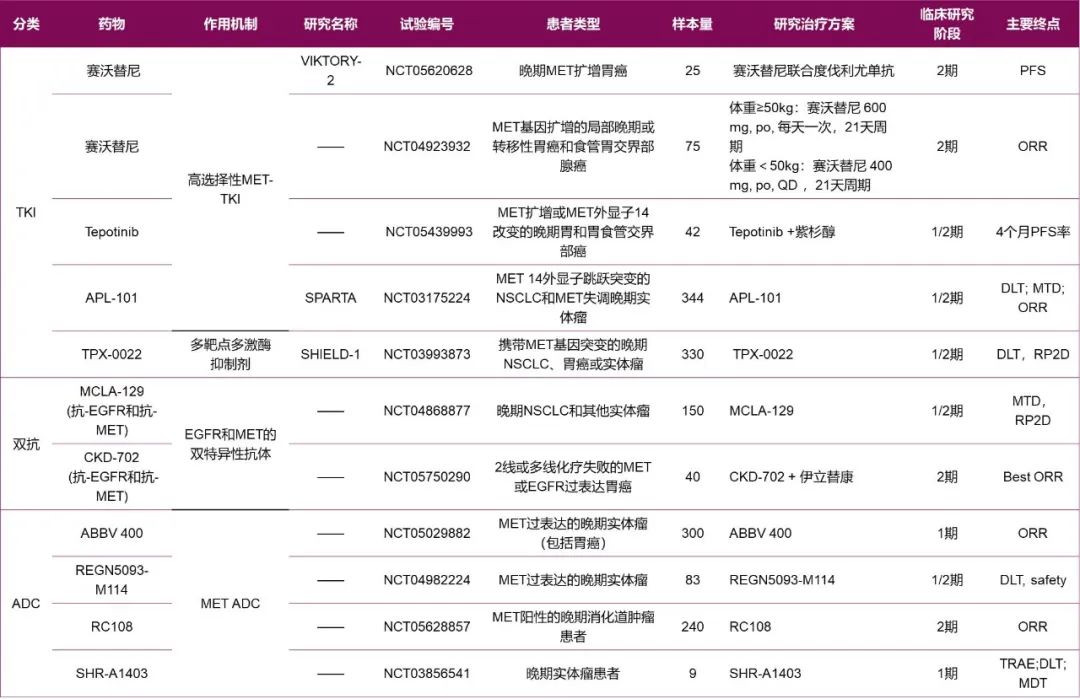 胃癌患者的治疗新策略:MET靶向治疗
胃癌患者的治疗新策略:MET靶向治疗
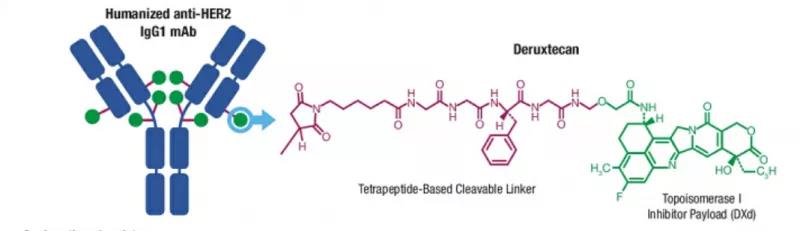 晚期胃癌靶向治疗的前世今生
晚期胃癌靶向治疗的前世今生
其他热门专题
 李子禹:晚期胃癌姑息手术外科观
李子禹:晚期胃癌姑息手术外科观
 晚期胃癌姑息手术的争议
晚期胃癌姑息手术的争议
 保留幽门功能的胃切除手术
保留幽门功能的胃切除手术
 比“微创”更“微创”的腹腔镜胃癌根治术:标本经自然通道取出(NOSE...
比“微创”更“微创”的腹腔镜胃癌根治术:标本经自然通道取出(NOSE...
 NCCN指南丨胃癌的放疗
NCCN指南丨胃癌的放疗
 胃癌的治疗与放疗原则
胃癌的治疗与放疗原则
 胃癌能做放疗吗?
胃癌能做放疗吗?
 胃肠道肿瘤的质子治疗(三):胃癌
胃肠道肿瘤的质子治疗(三):胃癌
 中西医结合联合胃肠外科治疗胃癌通补兼顾,有利恢复|熊新贵谈肿瘤...
中西医结合联合胃肠外科治疗胃癌通补兼顾,有利恢复|熊新贵谈肿瘤...
其他胃癌治疗专题
 【胃癌食疗篇】快收藏!进击化疗的饮食方子
【胃癌食疗篇】快收藏!进击化疗的饮食方子
 黄芪牛骨汤-胃癌患者升白食谱
黄芪牛骨汤-胃癌患者升白食谱
 胃癌患者化疗期间怎么吃
胃癌患者化疗期间怎么吃
 什么是抗血栓袜,术后要穿多少天?
什么是抗血栓袜,术后要穿多少天?
 手术前后饮食的注意事项有哪些呢?
手术前后饮食的注意事项有哪些呢?
 胃手术后就拉肚子是怎么回事?
胃手术后就拉肚子是怎么回事?
 拔除胃管后,如何恢复进食?
拔除胃管后,如何恢复进食?
 术后咽喉疼痛怎么办?
术后咽喉疼痛怎么办?
 什么是口服营养补充?
什么是口服营养补充?
 胃癌患者如何正确选择及使用口服营养补充制剂?...
胃癌患者如何正确选择及使用口服营养补充制剂?...
 腹腔镜胃癌手术患者使用口服营养补充的专家共识(2020版)...
腹腔镜胃癌手术患者使用口服营养补充的专家共识(2020版)...
 Br J Cancer:二甲双胍可改善胃腺癌患者的预后
Br J Cancer:二甲双胍可改善胃腺癌患者的预后
 花生衣煮水-胃癌化疗患者升血小板食谱
花生衣煮水-胃癌化疗患者升血小板食谱
 猪肝羹-胃癌贫血食谱
猪肝羹-胃癌贫血食谱
 红枣百合莲肉羹-胃癌贫血食谱
红枣百合莲肉羹-胃癌贫血食谱
其他胃癌护理专题
 做完胃镜后出现黑便正常吗?
做完胃镜后出现黑便正常吗?
 胃镜报告怎么看?
胃镜报告怎么看?
 胃镜知识合集|一步到“胃”,你必须要知道的事...
胃镜知识合集|一步到“胃”,你必须要知道的事...
 胃镜检查前的三大注意事项
胃镜检查前的三大注意事项
 胃癌胃镜活检标本HER-2检测中国专家共识(2023版)...
胃癌胃镜活检标本HER-2检测中国专家共识(2023版)...
 三次活检都是炎症,却最终确诊胃癌——难道『胃镜+病理』也不靠谱?...
三次活检都是炎症,却最终确诊胃癌——难道『胃镜+病理』也不靠谱?...
 中肿专家说丨做了胃镜,为何查不出早期胃癌?...
中肿专家说丨做了胃镜,为何查不出早期胃癌?...
 胃癌常用免疫组化指标解读,看这一篇就够了!...
胃癌常用免疫组化指标解读,看这一篇就够了!...
 胃癌治疗中腹腔镜检查的作用
胃癌治疗中腹腔镜检查的作用
 胃癌手术前如何对肿瘤进行分期?
胃癌手术前如何对肿瘤进行分期?
 胃癌分期CT怎么看?
胃癌分期CT怎么看?
 胃癌病人是否都要做PET-CT?
胃癌病人是否都要做PET-CT?
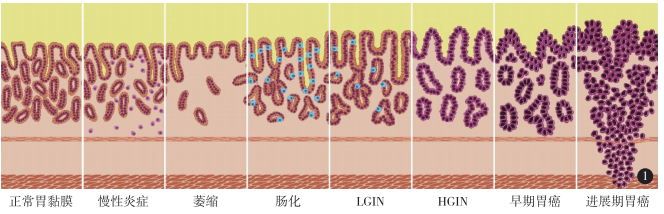 [共识]中国胃黏膜癌前状态及病变的处理策略专家共识(2020)...
[共识]中国胃黏膜癌前状态及病变的处理策略专家共识(2020)...
 胃癌前病变、类癌与胃癌
胃癌前病变、类癌与胃癌
 肠上皮化生是怎样演变为胃癌的?
肠上皮化生是怎样演变为胃癌的?
 1个月前发现癌前病变,1个月后揪出胃癌,早期!多亏这个精细检查...
1个月前发现癌前病变,1个月后揪出胃癌,早期!多亏这个精细检查...
其他诊断筛查专题
 上海美中嘉和肿瘤门诊部
上海
上海美中嘉和肿瘤门诊部
上海
 西南医院
重庆
西南医院
重庆
 中山大学附属第六医院
广州
中山大学附属第六医院
广州
 山东省公共卫生临床中心
济南
山东省公共卫生临床中心
济南
 南京鼓楼医院
南京
南京鼓楼医院
南京
 吉林大学白求恩第一医院
长春
吉林大学白求恩第一医院
长春
 重庆大学附属肿瘤医院
重庆
重庆大学附属肿瘤医院
重庆
 中山大学附属肿瘤医院
广州
中山大学附属肿瘤医院
广州
 云南省肿瘤医院
昆明
云南省肿瘤医院
昆明
 上海东方肝胆外科医院
上海
上海东方肝胆外科医院
上海
 中山大学附属第五医院
珠海
中山大学附属第五医院
珠海
 哈尔滨医科大学附属肿瘤医院
哈尔滨
哈尔滨医科大学附属肿瘤医院
哈尔滨
 上海市质子重离子医院
上海
上海市质子重离子医院
上海
 中国科学技术大学附属第一医院
合肥
中国科学技术大学附属第一医院
合肥
第95名 综合排名
 山东大学齐鲁医院
济南
山东大学齐鲁医院
济南
第24名 综合排名
 南京市胸科医院
南京
南京市胸科医院
南京
 四川省肿瘤医院
成都
四川省肿瘤医院
成都
 上海美中嘉和肿瘤门诊部
上海
上海美中嘉和肿瘤门诊部
上海
 中山大学附属第六医院
广州
中山大学附属第六医院
广州
 新桥医院
重庆
新桥医院
重庆
 山东省立医院
济南
山东省立医院
济南
第52名 综合排名
 广东省中医院
广州
广东省中医院
广州
 上海长征医院
上海
上海长征医院
上海
 南京鼓楼医院
南京
南京鼓楼医院
南京
 中国科大附一院
安徽
中国科大附一院
安徽
 山东省公共卫生临床中心
济南
山东省公共卫生临床中心
济南
 哈尔滨医科大学附属第一医院
哈尔滨
哈尔滨医科大学附属第一医院
哈尔滨
第78名 综合排名
 东部战区总医院
南京
东部战区总医院
南京
第58名 综合排名
 吉林大学白求恩第一医院
长春
吉林大学白求恩第一医院
长春
 上海市肺科医院
上海
上海市肺科医院
上海
第42名 综合排名
 苏州大学附属第一医院
苏州
苏州大学附属第一医院
苏州
第54名 综合排名
 中山大学附属肿瘤医院
广州
中山大学附属肿瘤医院
广州
 重庆大学附属肿瘤医院
重庆
重庆大学附属肿瘤医院
重庆
 中南大学湘雅医院
长沙
中南大学湘雅医院
长沙
第15名 综合排名
 上海市胸科医院
上海
上海市胸科医院
上海
第80名 综合排名
 上海市东方医院
上海
上海市东方医院
上海
 北京大学第一医院
北京
北京大学第一医院
北京
第12名 综合排名
 武汉大学人民医院
武汉
武汉大学人民医院
武汉
第40名 综合排名
 中山大学附属第五医院
珠海
中山大学附属第五医院
珠海
 上海东方肝胆外科医院
上海
上海东方肝胆外科医院
上海
 云南省肿瘤医院
昆明
云南省肿瘤医院
昆明
 北京胸科医院
北京
北京胸科医院
北京
第100名 综合排名
 哈尔滨医科大学附属肿瘤医院
哈尔滨
哈尔滨医科大学附属肿瘤医院
哈尔滨
 北京大学人民医院
北京
北京大学人民医院
北京
第21名 综合排名
 上海市质子重离子医院
上海
上海市质子重离子医院
上海
 中国科学技术大学附属第一医院
合肥
中国科学技术大学附属第一医院
合肥
第95名 综合排名
 深圳市第三人民医院
深圳
深圳市第三人民医院
深圳
 辽宁省肿瘤医院
沈阳
辽宁省肿瘤医院
沈阳
 南京市胸科医院
南京
南京市胸科医院
南京
 广东省人民医院
广州
广东省人民医院
广州
第34名 综合排名
 四川省肿瘤医院
成都
四川省肿瘤医院
成都
 复旦大学附属妇产科医院
上海
复旦大学附属妇产科医院
上海
第85名 综合排名
 中日友好医院
北京
中日友好医院
北京
第43名 综合排名
 上海美中嘉和肿瘤门诊部
上海
上海美中嘉和肿瘤门诊部
上海
 中山大学附属第六医院
广州
中山大学附属第六医院
广州
 浙江大学医学院附属妇产科医院
杭州
浙江大学医学院附属妇产科医院
杭州
第91名 综合排名
 广东省中医院
广州
广东省中医院
广州
 山东省立医院
济南
山东省立医院
济南
第52名 综合排名
 上海长征医院
上海
上海长征医院
上海
 南京鼓楼医院
南京
南京鼓楼医院
南京
 中国科大附一院
安徽
中国科大附一院
安徽
 山东省公共卫生临床中心
济南
山东省公共卫生临床中心
济南
 中山大学孙逸仙纪念医院
广州
中山大学孙逸仙纪念医院
广州
第64名 综合排名
 东部战区总医院
南京
东部战区总医院
南京
第58名 综合排名
 吉林大学白求恩第一医院
长春
吉林大学白求恩第一医院
长春
 上海市肺科医院
上海
上海市肺科医院
上海
第42名 综合排名
 中山大学附属肿瘤医院
广州
中山大学附属肿瘤医院
广州
 北京京西肿瘤医院
北京
北京京西肿瘤医院
北京
 重庆大学附属肿瘤医院
重庆
重庆大学附属肿瘤医院
重庆
 中南大学湘雅医院
长沙
中南大学湘雅医院
长沙
第15名 综合排名
 上海市胸科医院
上海
上海市胸科医院
上海
第80名 综合排名
 湖南省肿瘤医院
长沙
湖南省肿瘤医院
长沙
 华中科技大学同济医院
武汉
华中科技大学同济医院
武汉
 中国医科大学附属盛京医院
沈阳
中国医科大学附属盛京医院
沈阳
第33名 综合排名
 北京大学第一医院
北京
北京大学第一医院
北京
第12名 综合排名
 中山大学附属第五医院
珠海
中山大学附属第五医院
珠海
 哈尔滨医科大学附属肿瘤医院
哈尔滨
哈尔滨医科大学附属肿瘤医院
哈尔滨
 复旦大学附属华山医院
上海
复旦大学附属华山医院
上海
第8名 综合排名
 上海市东方医院
上海
上海市东方医院
上海
 上海东方肝胆外科医院
上海
上海东方肝胆外科医院
上海
 北京大学人民医院
北京
北京大学人民医院
北京
第21名 综合排名
 北京胸科医院
北京
北京胸科医院
北京
第100名 综合排名
 云南省肿瘤医院
昆明
云南省肿瘤医院
昆明
 上海市质子重离子医院
上海
上海市质子重离子医院
上海
 中国科学技术大学附属第一医院
合肥
中国科学技术大学附属第一医院
合肥
第95名 综合排名
 山东大学齐鲁医院
济南
山东大学齐鲁医院
济南
第24名 综合排名
 吉林省肿瘤医院
长春
吉林省肿瘤医院
长春
 杭州市肿瘤医院
杭州
杭州市肿瘤医院
杭州
 深圳市第三人民医院
深圳
深圳市第三人民医院
深圳
 辽宁省肿瘤医院
沈阳
辽宁省肿瘤医院
沈阳
 南京市胸科医院
南京
南京市胸科医院
南京
 广东省人民医院
广州
广东省人民医院
广州
第34名 综合排名
 复旦大学附属妇产科医院
上海
复旦大学附属妇产科医院
上海
第85名 综合排名
 中日友好医院
北京
中日友好医院
北京
第43名 综合排名
 上海美中嘉和肿瘤门诊部
上海
上海美中嘉和肿瘤门诊部
上海
 中山大学附属第六医院
广州
中山大学附属第六医院
广州
 西南医院
重庆
西南医院
重庆
 北部战区总医院
沈阳
北部战区总医院
沈阳
 浙江大学医学院附属妇产科医院
杭州
浙江大学医学院附属妇产科医院
杭州
第91名 综合排名
 广东省中医院
广州
广东省中医院
广州
 山东省立医院
济南
山东省立医院
济南
第52名 综合排名
 武汉大学中南医院
武汉
武汉大学中南医院
武汉
第55名 综合排名
 哈尔滨医科大学附属第二医院
哈尔滨
哈尔滨医科大学附属第二医院
哈尔滨
第67名 综合排名
 重庆医科大学附属第一医院
重庆
重庆医科大学附属第一医院
重庆
第48名 综合排名
 南京鼓楼医院
南京
南京鼓楼医院
南京
 中国科大附一院
安徽
中国科大附一院
安徽
 山东省公共卫生临床中心
济南
山东省公共卫生临床中心
济南
 中山大学孙逸仙纪念医院
广州
中山大学孙逸仙纪念医院
广州
第64名 综合排名
 新桥医院
重庆
新桥医院
重庆
 吉林大学白求恩第一医院
长春
吉林大学白求恩第一医院
长春
 301医院
北京
301医院
北京
 上海市肺科医院
上海
上海市肺科医院
上海
第42名 综合排名
 苏州大学附属第一医院
苏州
苏州大学附属第一医院
苏州
第54名 综合排名
 武汉大学人民医院
武汉
武汉大学人民医院
武汉
第40名 综合排名
 重庆大学附属肿瘤医院
重庆
重庆大学附属肿瘤医院
重庆
 中山大学附属肿瘤医院
广州
中山大学附属肿瘤医院
广州
 上海市第十人民医院
上海
上海市第十人民医院
上海
 浙江省肿瘤医院
杭州
浙江省肿瘤医院
杭州
第8名 肿瘤科排名
 中南大学湘雅医院
长沙
中南大学湘雅医院
长沙
第15名 综合排名
 上海交通大学医学院附属仁济医院
上海
上海交通大学医学院附属仁济医院
上海
第17名 综合排名
 复旦大学附属中山医院
上海
复旦大学附属中山医院
上海
第5名 综合排名
 北京京西肿瘤医院
北京
北京京西肿瘤医院
北京
 江苏省肿瘤医院
南京
江苏省肿瘤医院
南京
第9名 肿瘤科排名
 上海市胸科医院
上海
上海市胸科医院
上海
第80名 综合排名
 湖南省肿瘤医院
长沙
湖南省肿瘤医院
长沙
 中山大学附属第一医院
广州
中山大学附属第一医院
广州
第9名 综合排名
 北京医院
北京
北京医院
北京
第60名 综合排名
 华中科技大学同济医院
武汉
华中科技大学同济医院
武汉
 浙江大学医学院附属第一医院
杭州
浙江大学医学院附属第一医院
杭州
第10名 综合排名
 湖北省肿瘤医院
武汉
湖北省肿瘤医院
武汉
 中国医科大学附属盛京医院
沈阳
中国医科大学附属盛京医院
沈阳
第33名 综合排名
 浙大二院
杭州
浙大二院
杭州
 北京大学第一医院
北京
北京大学第一医院
北京
第12名 综合排名
 河南省肿瘤医院
郑州
河南省肿瘤医院
郑州
 上海长海医院
上海
上海长海医院
上海
 中山大学附属第五医院
珠海
中山大学附属第五医院
珠海
 浙江大学医学院附属邵逸夫医院
杭州
浙江大学医学院附属邵逸夫医院
杭州
第49名 综合排名
 复旦大学附属华山医院
上海
复旦大学附属华山医院
上海
第8名 综合排名
 上海市东方医院
上海
上海市东方医院
上海
 上海东方肝胆外科医院
上海
上海东方肝胆外科医院
上海
 云南省肿瘤医院
昆明
云南省肿瘤医院
昆明
 哈尔滨医科大学附属肿瘤医院
哈尔滨
哈尔滨医科大学附属肿瘤医院
哈尔滨
 北京大学人民医院
北京
北京大学人民医院
北京
第21名 综合排名
 北京胸科医院
北京
北京胸科医院
北京
第100名 综合排名
 上海市质子重离子医院
上海
上海市质子重离子医院
上海
 吉林省肿瘤医院
长春
吉林省肿瘤医院
长春
 杭州市肿瘤医院
杭州
杭州市肿瘤医院
杭州
 南京市胸科医院
南京
南京市胸科医院
南京
 中国科学技术大学附属第一医院
合肥
中国科学技术大学附属第一医院
合肥
第95名 综合排名
 西安交通大学第一附属医院
西安
西安交通大学第一附属医院
西安
第63名 综合排名
 深圳市第三人民医院
深圳
深圳市第三人民医院
深圳
 山西省肿瘤医院
太原
山西省肿瘤医院
太原
 中山大学附属第六医院
广州
中山大学附属第六医院
广州
 广东省人民医院
广州
广东省人民医院
广州
第34名 综合排名
 复旦大学附属妇产科医院
上海
复旦大学附属妇产科医院
上海
第85名 综合排名
 中日友好医院
北京
中日友好医院
北京
第43名 综合排名
 中山大学附属第三医院
广州
中山大学附属第三医院
广州
第45名 综合排名
 上海美中嘉和肿瘤门诊部
上海
上海美中嘉和肿瘤门诊部
上海
 北部战区总医院
沈阳
北部战区总医院
沈阳
 浙江大学医学院附属妇产科医院
杭州
浙江大学医学院附属妇产科医院
杭州
第91名 综合排名
 广东省中医院
广州
广东省中医院
广州
 山东省立医院
济南
山东省立医院
济南
第52名 综合排名
 武汉大学中南医院
武汉
武汉大学中南医院
武汉
第55名 综合排名
 上海长征医院
上海
上海长征医院
上海
 重庆医科大学附属第一医院
重庆
重庆医科大学附属第一医院
重庆
第48名 综合排名
 南京鼓楼医院
南京
南京鼓楼医院
南京
 中国科大附一院
安徽
中国科大附一院
安徽
 山东省公共卫生临床中心
济南
山东省公共卫生临床中心
济南
 福建医科大学附属第一医院
福州
福建医科大学附属第一医院
福州
第84名 综合排名
 新桥医院
重庆
新桥医院
重庆
 东部战区总医院
南京
东部战区总医院
南京
第58名 综合排名
 吉林大学白求恩第一医院
长春
吉林大学白求恩第一医院
长春
 301医院
北京
301医院
北京
 东南大学附属中大医院
南京
东南大学附属中大医院
南京
第46名 综合排名
 上海市肺科医院
上海
上海市肺科医院
上海
第42名 综合排名
 苏州大学附属第一医院
苏州
苏州大学附属第一医院
苏州
第54名 综合排名
 重庆大学附属肿瘤医院
重庆
重庆大学附属肿瘤医院
重庆
 中山大学附属肿瘤医院
广州
中山大学附属肿瘤医院
广州
 上海市第十人民医院
上海
上海市第十人民医院
上海
 浙江省肿瘤医院
杭州
浙江省肿瘤医院
杭州
第8名 肿瘤科排名
 中南大学湘雅医院
长沙
中南大学湘雅医院
长沙
第15名 综合排名
 北京医院
北京
北京医院
北京
第60名 综合排名
 上海交通大学医学院附属仁济医院
上海
上海交通大学医学院附属仁济医院
上海
第17名 综合排名
 复旦大学附属中山医院
上海
复旦大学附属中山医院
上海
第5名 综合排名
 北京京西肿瘤医院
北京
北京京西肿瘤医院
北京
 上海市胸科医院
上海
上海市胸科医院
上海
第80名 综合排名
 湖南省肿瘤医院
长沙
湖南省肿瘤医院
长沙
 上海新华医院
上海
上海新华医院
上海
 华中科技大学同济医院
武汉
华中科技大学同济医院
武汉
 上海市东方医院
上海
上海市东方医院
上海
 浙大二院
杭州
浙大二院
杭州
 浙江大学医学院附属第一医院
杭州
浙江大学医学院附属第一医院
杭州
第10名 综合排名
 湖北省肿瘤医院
武汉
湖北省肿瘤医院
武汉
 北京大学第一医院
北京
北京大学第一医院
北京
第12名 综合排名
 河南省肿瘤医院
郑州
河南省肿瘤医院
郑州
 武汉大学人民医院
武汉
武汉大学人民医院
武汉
第40名 综合排名
 中国医科大学附属盛京医院
沈阳
中国医科大学附属盛京医院
沈阳
第33名 综合排名
 上海长海医院
上海
上海长海医院
上海
 上海东方肝胆外科医院
上海
上海东方肝胆外科医院
上海
 复旦大学附属华山医院
上海
复旦大学附属华山医院
上海
第8名 综合排名
 广州泰和肿瘤医院
广州
广州泰和肿瘤医院
广州
 云南省肿瘤医院
昆明
云南省肿瘤医院
昆明
 北京胸科医院
北京
北京胸科医院
北京
第100名 综合排名
 中山大学附属第五医院
珠海
中山大学附属第五医院
珠海
 哈尔滨医科大学附属肿瘤医院
哈尔滨
哈尔滨医科大学附属肿瘤医院
哈尔滨
 北京大学人民医院
北京
北京大学人民医院
北京
第21名 综合排名
 上海市质子重离子医院
上海
上海市质子重离子医院
上海
 山东大学齐鲁医院
济南
山东大学齐鲁医院
济南
第24名 综合排名
 吉林省肿瘤医院
长春
吉林省肿瘤医院
长春
 南京市胸科医院
南京
南京市胸科医院
南京
 中国科学技术大学附属第一医院
合肥
中国科学技术大学附属第一医院
合肥
第95名 综合排名
 深圳市第三人民医院
深圳
深圳市第三人民医院
深圳
 山西省肿瘤医院
太原
山西省肿瘤医院
太原
 辽宁省肿瘤医院
沈阳
辽宁省肿瘤医院
沈阳
 中山大学附属第六医院
广州
中山大学附属第六医院
广州
 广东省人民医院
广州
广东省人民医院
广州
第34名 综合排名
 中日友好医院
北京
中日友好医院
北京
第43名 综合排名
 中山大学附属第三医院
广州
中山大学附属第三医院
广州
第45名 综合排名
 西南医院
重庆
西南医院
重庆
 上海美中嘉和肿瘤门诊部
上海
上海美中嘉和肿瘤门诊部
上海
 北部战区总医院
沈阳
北部战区总医院
沈阳
 浙江大学医学院附属妇产科医院
杭州
浙江大学医学院附属妇产科医院
杭州
第91名 综合排名
 山东省立医院
济南
山东省立医院
济南
第52名 综合排名
 武汉大学中南医院
武汉
武汉大学中南医院
武汉
第55名 综合排名
 广东省中医院
广州
广东省中医院
广州
 上海长征医院
上海
上海长征医院
上海
 南京鼓楼医院
南京
南京鼓楼医院
南京
 中国科大附一院
安徽
中国科大附一院
安徽
 山东省公共卫生临床中心
济南
山东省公共卫生临床中心
济南
 重庆医科大学附属第一医院
重庆
重庆医科大学附属第一医院
重庆
第48名 综合排名
 福建医科大学附属协和医院
福州
福建医科大学附属协和医院
福州
第88名 综合排名
 广州医科大学附属第一医院
广州
广州医科大学附属第一医院
广州
第31名 综合排名
 中山大学孙逸仙纪念医院
广州
中山大学孙逸仙纪念医院
广州
第64名 综合排名
 福建医科大学附属第一医院
福州
福建医科大学附属第一医院
福州
第84名 综合排名
 新桥医院
重庆
新桥医院
重庆
 东部战区总医院
南京
东部战区总医院
南京
第58名 综合排名
 吉林大学白求恩第一医院
长春
吉林大学白求恩第一医院
长春
 301医院
北京
301医院
北京
 上海市肺科医院
上海
上海市肺科医院
上海
第42名 综合排名
 苏州大学附属第一医院
苏州
苏州大学附属第一医院
苏州
第54名 综合排名
 重庆大学附属肿瘤医院
重庆
重庆大学附属肿瘤医院
重庆
 中山大学附属肿瘤医院
广州
中山大学附属肿瘤医院
广州
 上海市第十人民医院
上海
上海市第十人民医院
上海
 中南大学湘雅医院
长沙
中南大学湘雅医院
长沙
第15名 综合排名
 北京医院
北京
北京医院
北京
第60名 综合排名
 上海交通大学医学院附属仁济医院
上海
上海交通大学医学院附属仁济医院
上海
第17名 综合排名
 复旦大学附属中山医院
上海
复旦大学附属中山医院
上海
第5名 综合排名
 北京京西肿瘤医院
北京
北京京西肿瘤医院
北京
 江苏省肿瘤医院
南京
江苏省肿瘤医院
南京
第9名 肿瘤科排名
 上海交通大学医学院附属瑞金医院
上海
上海交通大学医学院附属瑞金医院
上海
第4名 综合排名
 上海市胸科医院
上海
上海市胸科医院
上海
第80名 综合排名
 湖南省肿瘤医院
长沙
湖南省肿瘤医院
长沙
 上海新华医院
上海
上海新华医院
上海
 中山大学附属第一医院
广州
中山大学附属第一医院
广州
第9名 综合排名
 华中科技大学同济医院
武汉
华中科技大学同济医院
武汉
 浙江大学医学院附属第一医院
杭州
浙江大学医学院附属第一医院
杭州
第10名 综合排名
 浙大二院
杭州
浙大二院
杭州
 北京大学第一医院
北京
北京大学第一医院
北京
第12名 综合排名
 武汉大学人民医院
武汉
武汉大学人民医院
武汉
第40名 综合排名
 河南省肿瘤医院
郑州
河南省肿瘤医院
郑州
 上海长海医院
上海
上海长海医院
上海
 中山大学附属第五医院
珠海
中山大学附属第五医院
珠海
 浙江大学医学院附属邵逸夫医院
杭州
浙江大学医学院附属邵逸夫医院
杭州
第49名 综合排名
 复旦大学附属华山医院
上海
复旦大学附属华山医院
上海
第8名 综合排名
 广州泰和肿瘤医院
广州
广州泰和肿瘤医院
广州
 上海市东方医院
上海
上海市东方医院
上海
 上海东方肝胆外科医院
上海
上海东方肝胆外科医院
上海
 云南省肿瘤医院
昆明
云南省肿瘤医院
昆明
 哈尔滨医科大学附属肿瘤医院
哈尔滨
哈尔滨医科大学附属肿瘤医院
哈尔滨
 北京大学人民医院
北京
北京大学人民医院
北京
第21名 综合排名
 北京胸科医院
北京
北京胸科医院
北京
第100名 综合排名
 上海市质子重离子医院
上海
上海市质子重离子医院
上海
 山东大学齐鲁医院
济南
山东大学齐鲁医院
济南
第24名 综合排名
 吉林省肿瘤医院
长春
吉林省肿瘤医院
长春
 杭州市肿瘤医院
杭州
杭州市肿瘤医院
杭州
 南京市胸科医院
南京
南京市胸科医院
南京
 中国科学技术大学附属第一医院
合肥
中国科学技术大学附属第一医院
合肥
第95名 综合排名
 深圳市第三人民医院
深圳
深圳市第三人民医院
深圳
 山西省肿瘤医院
太原
山西省肿瘤医院
太原
 中山大学附属第六医院
广州
中山大学附属第六医院
广州
 广东省人民医院
广州
广东省人民医院
广州
第34名 综合排名
 四川省肿瘤医院
成都
四川省肿瘤医院
成都
 复旦大学附属妇产科医院
上海
复旦大学附属妇产科医院
上海
第85名 综合排名
 中日友好医院
北京
中日友好医院
北京
第43名 综合排名
 中山大学附属第三医院
广州
中山大学附属第三医院
广州
第45名 综合排名
 上海美中嘉和肿瘤门诊部
上海
上海美中嘉和肿瘤门诊部
上海
 北部战区总医院
沈阳
北部战区总医院
沈阳
 浙江大学医学院附属妇产科医院
杭州
浙江大学医学院附属妇产科医院
杭州
第91名 综合排名
 山东省立医院
济南
山东省立医院
济南
第52名 综合排名
 武汉大学中南医院
武汉
武汉大学中南医院
武汉
第55名 综合排名
 四川省人民医院
成都
四川省人民医院
成都
第38名 综合排名
 上海长征医院
上海
上海长征医院
上海
 南京鼓楼医院
南京
南京鼓楼医院
南京
 中国科大附一院
安徽
中国科大附一院
安徽
 山东省公共卫生临床中心
济南
山东省公共卫生临床中心
济南
 重庆医科大学附属第一医院
重庆
重庆医科大学附属第一医院
重庆
第48名 综合排名
 中山大学孙逸仙纪念医院
广州
中山大学孙逸仙纪念医院
广州
第64名 综合排名
 哈尔滨医科大学附属第一医院
哈尔滨
哈尔滨医科大学附属第一医院
哈尔滨
第78名 综合排名
 福建医科大学附属第一医院
福州
福建医科大学附属第一医院
福州
第84名 综合排名
 新桥医院
重庆
新桥医院
重庆
 吉林大学白求恩第一医院
长春
吉林大学白求恩第一医院
长春
 301医院
北京
301医院
北京
 东南大学附属中大医院
南京
东南大学附属中大医院
南京
第46名 综合排名
 上海市肺科医院
上海
上海市肺科医院
上海
第42名 综合排名
 重庆大学附属肿瘤医院
重庆
重庆大学附属肿瘤医院
重庆
 中山大学附属肿瘤医院
广州
中山大学附属肿瘤医院
广州
 上海市第十人民医院
上海
上海市第十人民医院
上海
 中南大学湘雅医院
长沙
中南大学湘雅医院
长沙
第15名 综合排名
 北京医院
北京
北京医院
北京
第60名 综合排名
 上海交通大学医学院附属仁济医院
上海
上海交通大学医学院附属仁济医院
上海
第17名 综合排名
 复旦大学附属中山医院
上海
复旦大学附属中山医院
上海
第5名 综合排名
 北京京西肿瘤医院
北京
北京京西肿瘤医院
北京
 上海交通大学医学院附属瑞金医院
上海
上海交通大学医学院附属瑞金医院
上海
第4名 综合排名
 上海市胸科医院
上海
上海市胸科医院
上海
第80名 综合排名
 湖南省肿瘤医院
长沙
湖南省肿瘤医院
长沙
 上海新华医院
上海
上海新华医院
上海
 中山大学附属第一医院
广州
中山大学附属第一医院
广州
第9名 综合排名
 华中科技大学同济医院
武汉
华中科技大学同济医院
武汉
 湖北省肿瘤医院
武汉
湖北省肿瘤医院
武汉
 中国医科大学附属盛京医院
沈阳
中国医科大学附属盛京医院
沈阳
第33名 综合排名
 浙大二院
杭州
浙大二院
杭州
 北京大学第一医院
北京
北京大学第一医院
北京
第12名 综合排名
 武汉大学人民医院
武汉
武汉大学人民医院
武汉
第40名 综合排名
 河南省肿瘤医院
郑州
河南省肿瘤医院
郑州
 中山大学附属第五医院
珠海
中山大学附属第五医院
珠海
 复旦大学附属华山医院
上海
复旦大学附属华山医院
上海
第8名 综合排名
 广州泰和肿瘤医院
广州
广州泰和肿瘤医院
广州
 上海市东方医院
上海
上海市东方医院
上海
 上海东方肝胆外科医院
上海
上海东方肝胆外科医院
上海
 云南省肿瘤医院
昆明
云南省肿瘤医院
昆明
 哈尔滨医科大学附属肿瘤医院
哈尔滨
哈尔滨医科大学附属肿瘤医院
哈尔滨
 北京大学人民医院
北京
北京大学人民医院
北京
第21名 综合排名
 北京胸科医院
北京
北京胸科医院
北京
第100名 综合排名
 上海市质子重离子医院
上海
上海市质子重离子医院
上海
 西安交通大学第一附属医院
西安
西安交通大学第一附属医院
西安
第63名 综合排名
 吉林省肿瘤医院
长春
吉林省肿瘤医院
长春
 辽宁省肿瘤医院
沈阳
辽宁省肿瘤医院
沈阳
 浙江大学医学院附属妇产科医院
杭州
浙江大学医学院附属妇产科医院
杭州
第91名 综合排名
 北部战区总医院
沈阳
北部战区总医院
沈阳
 山西省肿瘤医院
太原
山西省肿瘤医院
太原
 杭州市肿瘤医院
杭州
杭州市肿瘤医院
杭州
 南京市胸科医院
南京
南京市胸科医院
南京
 中日友好医院
北京
中日友好医院
北京
第43名 综合排名
 广东省人民医院
广州
广东省人民医院
广州
第34名 综合排名
 四川省肿瘤医院
成都
四川省肿瘤医院
成都
 中山大学附属第三医院
广州
中山大学附属第三医院
广州
第45名 综合排名
 上海美中嘉和肿瘤门诊部
上海
上海美中嘉和肿瘤门诊部
上海
 中山大学附属第六医院
广州
中山大学附属第六医院
广州
 西南医院
重庆
西南医院
重庆
 新桥医院
重庆
新桥医院
重庆
 广东省中医院
广州
广东省中医院
广州
 山东省立医院
济南
山东省立医院
济南
第52名 综合排名
 武汉大学中南医院
武汉
武汉大学中南医院
武汉
第55名 综合排名
 上海长征医院
上海
上海长征医院
上海
 厦门大学附属第一医院
厦门
厦门大学附属第一医院
厦门
 南京鼓楼医院
南京
南京鼓楼医院
南京
 中国科大附一院
安徽
中国科大附一院
安徽
 山东省公共卫生临床中心
济南
山东省公共卫生临床中心
济南
 重庆医科大学附属第一医院
重庆
重庆医科大学附属第一医院
重庆
第48名 综合排名
 四川省人民医院
成都
四川省人民医院
成都
第38名 综合排名
 吉林大学白求恩第一医院
长春
吉林大学白求恩第一医院
长春
 东部战区总医院
南京
东部战区总医院
南京
第58名 综合排名
 哈尔滨医科大学附属第一医院
哈尔滨
哈尔滨医科大学附属第一医院
哈尔滨
第78名 综合排名
 上海市肺科医院
上海
上海市肺科医院
上海
第42名 综合排名
 复旦大学附属妇产科医院
上海
复旦大学附属妇产科医院
上海
第85名 综合排名
 重庆大学附属肿瘤医院
重庆
重庆大学附属肿瘤医院
重庆
 中山大学附属肿瘤医院
广州
中山大学附属肿瘤医院
广州
 上海市第十人民医院
上海
上海市第十人民医院
上海
 中南大学湘雅医院
长沙
中南大学湘雅医院
长沙
第15名 综合排名
 华中科技大学同济医院
武汉
华中科技大学同济医院
武汉
 北京医院
北京
北京医院
北京
第60名 综合排名
 上海交通大学医学院附属仁济医院
上海
上海交通大学医学院附属仁济医院
上海
第17名 综合排名
 北京京西肿瘤医院
北京
北京京西肿瘤医院
北京
 上海市胸科医院
上海
上海市胸科医院
上海
第80名 综合排名
 湖南省肿瘤医院
长沙
湖南省肿瘤医院
长沙
 上海新华医院
上海
上海新华医院
上海
 江苏省肿瘤医院
南京
江苏省肿瘤医院
南京
第9名 肿瘤科排名
 南方医科大学南方医院
广州
南方医科大学南方医院
广州
第18名 综合排名
 上海市东方医院
上海
上海市东方医院
上海
 浙江大学医学院附属第一医院
杭州
浙江大学医学院附属第一医院
杭州
第10名 综合排名
 湖北省肿瘤医院
武汉
湖北省肿瘤医院
武汉
 北京大学第一医院
北京
北京大学第一医院
北京
第12名 综合排名
 河南省肿瘤医院
郑州
河南省肿瘤医院
郑州
 苏州大学附属第一医院
苏州
苏州大学附属第一医院
苏州
第54名 综合排名
 武汉大学人民医院
武汉
武汉大学人民医院
武汉
第40名 综合排名
 中国医科大学附属盛京医院
沈阳
中国医科大学附属盛京医院
沈阳
第33名 综合排名
 上海东方肝胆外科医院
上海
上海东方肝胆外科医院
上海
 复旦大学附属华山医院
上海
复旦大学附属华山医院
上海
第8名 综合排名
 广州泰和肿瘤医院
广州
广州泰和肿瘤医院
广州
 云南省肿瘤医院
昆明
云南省肿瘤医院
昆明
 北京胸科医院
北京
北京胸科医院
北京
第100名 综合排名
 中山大学附属第五医院
珠海
中山大学附属第五医院
珠海
 哈尔滨医科大学附属肿瘤医院
哈尔滨
哈尔滨医科大学附属肿瘤医院
哈尔滨
 北京大学人民医院
北京
北京大学人民医院
北京
第21名 综合排名
 上海市质子重离子医院
上海
上海市质子重离子医院
上海
 西安交通大学第一附属医院
西安
西安交通大学第一附属医院
西安
第63名 综合排名
 中国科学技术大学附属第一医院
合肥
中国科学技术大学附属第一医院
合肥
第95名 综合排名
 山东大学齐鲁医院
济南
山东大学齐鲁医院
济南
第24名 综合排名
 吉林省肿瘤医院
长春
吉林省肿瘤医院
长春
 辽宁省肿瘤医院
沈阳
辽宁省肿瘤医院
沈阳
 浙江大学医学院附属妇产科医院
杭州
浙江大学医学院附属妇产科医院
杭州
第91名 综合排名
 北部战区总医院
沈阳
北部战区总医院
沈阳
 深圳市第三人民医院
深圳
深圳市第三人民医院
深圳
 山西省肿瘤医院
太原
山西省肿瘤医院
太原
 杭州市肿瘤医院
杭州
杭州市肿瘤医院
杭州
 南京市胸科医院
南京
南京市胸科医院
南京
 中日友好医院
北京
中日友好医院
北京
第43名 综合排名
 福建省肿瘤医院
福州
福建省肿瘤医院
福州
 广东省人民医院
广州
广东省人民医院
广州
第34名 综合排名
 四川省肿瘤医院
成都
四川省肿瘤医院
成都
 中山大学附属第三医院
广州
中山大学附属第三医院
广州
第45名 综合排名
 上海美中嘉和肿瘤门诊部
上海
上海美中嘉和肿瘤门诊部
上海
 中山大学附属第六医院
广州
中山大学附属第六医院
广州
 西南医院
重庆
西南医院
重庆
 新桥医院
重庆
新桥医院
重庆
 福建医科大学附属第一医院
福州
福建医科大学附属第一医院
福州
第84名 综合排名
 广东省中医院
广州
广东省中医院
广州
 山东省立医院
济南
山东省立医院
济南
第52名 综合排名
 武汉大学中南医院
武汉
武汉大学中南医院
武汉
第55名 综合排名
 中南大学湘雅二医院
长沙
中南大学湘雅二医院
长沙
第20名 综合排名
 上海长征医院
上海
上海长征医院
上海
 厦门大学附属第一医院
厦门
厦门大学附属第一医院
厦门
 南京鼓楼医院
南京
南京鼓楼医院
南京
 中国科大附一院
安徽
中国科大附一院
安徽
 山东省公共卫生临床中心
济南
山东省公共卫生临床中心
济南
 重庆医科大学附属第一医院
重庆
重庆医科大学附属第一医院
重庆
第48名 综合排名
 四川省人民医院
成都
四川省人民医院
成都
第38名 综合排名
 哈尔滨医科大学附属第二医院
哈尔滨
哈尔滨医科大学附属第二医院
哈尔滨
第67名 综合排名
 吉林大学白求恩第一医院
长春
吉林大学白求恩第一医院
长春
 东部战区总医院
南京
东部战区总医院
南京
第58名 综合排名
 中山大学孙逸仙纪念医院
广州
中山大学孙逸仙纪念医院
广州
第64名 综合排名
 哈尔滨医科大学附属第一医院
哈尔滨
哈尔滨医科大学附属第一医院
哈尔滨
第78名 综合排名
 上海市肺科医院
上海
上海市肺科医院
上海
第42名 综合排名
 东南大学附属中大医院
南京
东南大学附属中大医院
南京
第46名 综合排名
 福建医科大学附属协和医院
福州
福建医科大学附属协和医院
福州
第88名 综合排名
 广州医科大学附属第一医院
广州
广州医科大学附属第一医院
广州
第31名 综合排名
 301医院
北京
301医院
北京
 复旦大学附属妇产科医院
上海
复旦大学附属妇产科医院
上海
第85名 综合排名
 重庆大学附属肿瘤医院
重庆
重庆大学附属肿瘤医院
重庆
 中山大学附属肿瘤医院
广州
中山大学附属肿瘤医院
广州
 上海市第十人民医院
上海
上海市第十人民医院
上海
 中南大学湘雅医院
长沙
中南大学湘雅医院
长沙
第15名 综合排名
 复旦大学附属中山医院
上海
复旦大学附属中山医院
上海
第5名 综合排名
 华中科技大学同济医院
武汉
华中科技大学同济医院
武汉
 北京医院
北京
北京医院
北京
第60名 综合排名
 上海交通大学医学院附属仁济医院
上海
上海交通大学医学院附属仁济医院
上海
第17名 综合排名
 浙江省肿瘤医院
杭州
浙江省肿瘤医院
杭州
第8名 肿瘤科排名
 北京京西肿瘤医院
北京
北京京西肿瘤医院
北京
 上海交通大学医学院附属瑞金医院
上海
上海交通大学医学院附属瑞金医院
上海
第4名 综合排名
 上海市胸科医院
上海
上海市胸科医院
上海
第80名 综合排名
 湖南省肿瘤医院
长沙
湖南省肿瘤医院
长沙
 上海新华医院
上海
上海新华医院
上海
 江苏省肿瘤医院
南京
江苏省肿瘤医院
南京
第9名 肿瘤科排名
 中山大学附属第一医院
广州
中山大学附属第一医院
广州
第9名 综合排名
 南方医科大学南方医院
广州
南方医科大学南方医院
广州
第18名 综合排名
 上海市东方医院
上海
上海市东方医院
上海
 浙大二院
杭州
浙大二院
杭州
 浙江大学医学院附属第一医院
杭州
浙江大学医学院附属第一医院
杭州
第10名 综合排名
 湖北省肿瘤医院
武汉
湖北省肿瘤医院
武汉
 北京大学第一医院
北京
北京大学第一医院
北京
第12名 综合排名
 河南省肿瘤医院
郑州
河南省肿瘤医院
郑州
 武汉大学人民医院
武汉
武汉大学人民医院
武汉
第40名 综合排名
 中国医科大学附属盛京医院
沈阳
中国医科大学附属盛京医院
沈阳
第33名 综合排名
 上海长海医院
上海
上海长海医院
上海
 上海东方肝胆外科医院
上海
上海东方肝胆外科医院
上海
 浙江大学医学院附属邵逸夫医院
杭州
浙江大学医学院附属邵逸夫医院
杭州
第49名 综合排名
 复旦大学附属华山医院
上海
复旦大学附属华山医院
上海
第8名 综合排名
 广州泰和肿瘤医院
广州
广州泰和肿瘤医院
广州
 云南省肿瘤医院
昆明
云南省肿瘤医院
昆明
 北京胸科医院
北京
北京胸科医院
北京
第100名 综合排名
 中山大学附属第五医院
珠海
中山大学附属第五医院
珠海
 哈尔滨医科大学附属肿瘤医院
哈尔滨
哈尔滨医科大学附属肿瘤医院
哈尔滨
 北京大学人民医院
北京
北京大学人民医院
北京
第21名 综合排名
 上海市质子重离子医院
上海
上海市质子重离子医院
上海
 中国科学技术大学附属第一医院
合肥
中国科学技术大学附属第一医院
合肥
第95名 综合排名
 吉林省肿瘤医院
长春
吉林省肿瘤医院
长春
 浙江大学医学院附属妇产科医院
杭州
浙江大学医学院附属妇产科医院
杭州
第91名 综合排名
 北部战区总医院
沈阳
北部战区总医院
沈阳
 深圳市第三人民医院
深圳
深圳市第三人民医院
深圳
 山西省肿瘤医院
太原
山西省肿瘤医院
太原
 杭州市肿瘤医院
杭州
杭州市肿瘤医院
杭州
 南京市胸科医院
南京
南京市胸科医院
南京
 中日友好医院
北京
中日友好医院
北京
第43名 综合排名
 广东省人民医院
广州
广东省人民医院
广州
第34名 综合排名
 四川省肿瘤医院
成都
四川省肿瘤医院
成都
 中山大学附属第三医院
广州
中山大学附属第三医院
广州
第45名 综合排名
 上海美中嘉和肿瘤门诊部
上海
上海美中嘉和肿瘤门诊部
上海
 中山大学附属第六医院
广州
中山大学附属第六医院
广州
 西南医院
重庆
西南医院
重庆
 新桥医院
重庆
新桥医院
重庆
 广东省中医院
广州
广东省中医院
广州
 山东省立医院
济南
山东省立医院
济南
第52名 综合排名
 武汉大学中南医院
武汉
武汉大学中南医院
武汉
第55名 综合排名
 中南大学湘雅二医院
长沙
中南大学湘雅二医院
长沙
第20名 综合排名
 上海长征医院
上海
上海长征医院
上海
 厦门大学附属第一医院
厦门
厦门大学附属第一医院
厦门
 南京鼓楼医院
南京
南京鼓楼医院
南京
 中国科大附一院
安徽
中国科大附一院
安徽
 山东省公共卫生临床中心
济南
山东省公共卫生临床中心
济南
 重庆医科大学附属第一医院
重庆
重庆医科大学附属第一医院
重庆
第48名 综合排名
 四川省人民医院
成都
四川省人民医院
成都
第38名 综合排名
 吉林大学白求恩第一医院
长春
吉林大学白求恩第一医院
长春
 东部战区总医院
南京
东部战区总医院
南京
第58名 综合排名
 中山大学孙逸仙纪念医院
广州
中山大学孙逸仙纪念医院
广州
第64名 综合排名
 哈尔滨医科大学附属第一医院
哈尔滨
哈尔滨医科大学附属第一医院
哈尔滨
第78名 综合排名
 上海市肺科医院
上海
上海市肺科医院
上海
第42名 综合排名
 301医院
北京
301医院
北京
 复旦大学附属妇产科医院
上海
复旦大学附属妇产科医院
上海
第85名 综合排名
 重庆大学附属肿瘤医院
重庆
重庆大学附属肿瘤医院
重庆
 中山大学附属肿瘤医院
广州
中山大学附属肿瘤医院
广州
 上海市第十人民医院
上海
上海市第十人民医院
上海
 中南大学湘雅医院
长沙
中南大学湘雅医院
长沙
第15名 综合排名
 复旦大学附属中山医院
上海
复旦大学附属中山医院
上海
第5名 综合排名
 华中科技大学同济医院
武汉
华中科技大学同济医院
武汉
 北京医院
北京
北京医院
北京
第60名 综合排名
 上海交通大学医学院附属仁济医院
上海
上海交通大学医学院附属仁济医院
上海
第17名 综合排名
 北京京西肿瘤医院
北京
北京京西肿瘤医院
北京
 上海交通大学医学院附属瑞金医院
上海
上海交通大学医学院附属瑞金医院
上海
第4名 综合排名
 湖南省肿瘤医院
长沙
湖南省肿瘤医院
长沙
 上海新华医院
上海
上海新华医院
上海
 江苏省肿瘤医院
南京
江苏省肿瘤医院
南京
第9名 肿瘤科排名
 中山大学附属第一医院
广州
中山大学附属第一医院
广州
第9名 综合排名
 南方医科大学南方医院
广州
南方医科大学南方医院
广州
第18名 综合排名
 上海市东方医院
上海
上海市东方医院
上海
 浙大二院
杭州
浙大二院
杭州
 浙江大学医学院附属第一医院
杭州
浙江大学医学院附属第一医院
杭州
第10名 综合排名
 湖北省肿瘤医院
武汉
湖北省肿瘤医院
武汉
 北京大学第一医院
北京
北京大学第一医院
北京
第12名 综合排名
 河南省肿瘤医院
郑州
河南省肿瘤医院
郑州
 苏州大学附属第一医院
苏州
苏州大学附属第一医院
苏州
第54名 综合排名
 武汉大学人民医院
武汉
武汉大学人民医院
武汉
第40名 综合排名
 中国医科大学附属盛京医院
沈阳
中国医科大学附属盛京医院
沈阳
第33名 综合排名
 上海东方肝胆外科医院
上海
上海东方肝胆外科医院
上海
 复旦大学附属华山医院
上海
复旦大学附属华山医院
上海
第8名 综合排名
 广州泰和肿瘤医院
广州
广州泰和肿瘤医院
广州
 云南省肿瘤医院
昆明
云南省肿瘤医院
昆明
 北京胸科医院
北京
北京胸科医院
北京
第100名 综合排名
 中山大学附属第五医院
珠海
中山大学附属第五医院
珠海
 哈尔滨医科大学附属肿瘤医院
哈尔滨
哈尔滨医科大学附属肿瘤医院
哈尔滨
 北京大学人民医院
北京
北京大学人民医院
北京
第21名 综合排名
 上海市质子重离子医院
上海
上海市质子重离子医院
上海
 西安交通大学第一附属医院
西安
西安交通大学第一附属医院
西安
第63名 综合排名
 中国科学技术大学附属第一医院
合肥
中国科学技术大学附属第一医院
合肥
第95名 综合排名
 吉林省肿瘤医院
长春
吉林省肿瘤医院
长春
 辽宁省肿瘤医院
沈阳
辽宁省肿瘤医院
沈阳
 浙江大学医学院附属妇产科医院
杭州
浙江大学医学院附属妇产科医院
杭州
第91名 综合排名
 深圳市第三人民医院
深圳
深圳市第三人民医院
深圳
 山西省肿瘤医院
太原
山西省肿瘤医院
太原
 杭州市肿瘤医院
杭州
杭州市肿瘤医院
杭州
 南京市胸科医院
南京
南京市胸科医院
南京
 中日友好医院
北京
中日友好医院
北京
第43名 综合排名
 福建省肿瘤医院
福州
福建省肿瘤医院
福州
 广东省人民医院
广州
广东省人民医院
广州
第34名 综合排名
 四川省肿瘤医院
成都
四川省肿瘤医院
成都
 中山大学附属第三医院
广州
中山大学附属第三医院
广州
第45名 综合排名
 上海美中嘉和肿瘤门诊部
上海
上海美中嘉和肿瘤门诊部
上海
 中山大学附属第六医院
广州
中山大学附属第六医院
广州
 福建医科大学附属第一医院
福州
福建医科大学附属第一医院
福州
第84名 综合排名
 广东省中医院
广州
广东省中医院
广州
 山东省立医院
济南
山东省立医院
济南
第52名 综合排名
 武汉大学中南医院
武汉
武汉大学中南医院
武汉
第55名 综合排名
 上海长征医院
上海
上海长征医院
上海
 厦门大学附属第一医院
厦门
厦门大学附属第一医院
厦门
 南京鼓楼医院
南京
南京鼓楼医院
南京
 中国科大附一院
安徽
中国科大附一院
安徽
 山东省公共卫生临床中心
济南
山东省公共卫生临床中心
济南
 重庆医科大学附属第一医院
重庆
重庆医科大学附属第一医院
重庆
第48名 综合排名
 中南大学湘雅二医院
长沙
中南大学湘雅二医院
长沙
第20名 综合排名
 四川省人民医院
成都
四川省人民医院
成都
第38名 综合排名
 吉林大学白求恩第一医院
长春
吉林大学白求恩第一医院
长春
 东部战区总医院
南京
东部战区总医院
南京
第58名 综合排名
 中山大学孙逸仙纪念医院
广州
中山大学孙逸仙纪念医院
广州
第64名 综合排名
 哈尔滨医科大学附属第一医院
哈尔滨
哈尔滨医科大学附属第一医院
哈尔滨
第78名 综合排名
 上海市肺科医院
上海
上海市肺科医院
上海
第42名 综合排名
 东南大学附属中大医院
南京
东南大学附属中大医院
南京
第46名 综合排名
 哈尔滨医科大学附属第二医院
哈尔滨
哈尔滨医科大学附属第二医院
哈尔滨
第67名 综合排名
 复旦大学附属妇产科医院
上海
复旦大学附属妇产科医院
上海
第85名 综合排名
 重庆大学附属肿瘤医院
重庆
重庆大学附属肿瘤医院
重庆
 中山大学附属肿瘤医院
广州
中山大学附属肿瘤医院
广州
 上海市第十人民医院
上海
上海市第十人民医院
上海
 中南大学湘雅医院
长沙
中南大学湘雅医院
长沙
第15名 综合排名
 复旦大学附属中山医院
上海
复旦大学附属中山医院
上海
第5名 综合排名
 华中科技大学同济医院
武汉
华中科技大学同济医院
武汉
 北京医院
北京
北京医院
北京
第60名 综合排名
 上海交通大学医学院附属仁济医院
上海
上海交通大学医学院附属仁济医院
上海
第17名 综合排名
 浙江省肿瘤医院
杭州
浙江省肿瘤医院
杭州
第8名 肿瘤科排名
 北京京西肿瘤医院
北京
北京京西肿瘤医院
北京
 上海交通大学医学院附属瑞金医院
上海
上海交通大学医学院附属瑞金医院
上海
第4名 综合排名
 上海市胸科医院
上海
上海市胸科医院
上海
第80名 综合排名
 上海新华医院
上海
上海新华医院
上海
 江苏省肿瘤医院
南京
江苏省肿瘤医院
南京
第9名 肿瘤科排名
 中山大学附属第一医院
广州
中山大学附属第一医院
广州
第9名 综合排名
 上海市东方医院
上海
上海市东方医院
上海
 浙大二院
杭州
浙大二院
杭州
 浙江大学医学院附属第一医院
杭州
浙江大学医学院附属第一医院
杭州
第10名 综合排名
 湖北省肿瘤医院
武汉
湖北省肿瘤医院
武汉
 北京大学第一医院
北京
北京大学第一医院
北京
第12名 综合排名
 河南省肿瘤医院
郑州
河南省肿瘤医院
郑州
 武汉大学人民医院
武汉
武汉大学人民医院
武汉
第40名 综合排名
 中国医科大学附属盛京医院
沈阳
中国医科大学附属盛京医院
沈阳
第33名 综合排名
 上海长海医院
上海
上海长海医院
上海
 上海东方肝胆外科医院
上海
上海东方肝胆外科医院
上海
 浙江大学医学院附属邵逸夫医院
杭州
浙江大学医学院附属邵逸夫医院
杭州
第49名 综合排名
 复旦大学附属华山医院
上海
复旦大学附属华山医院
上海
第8名 综合排名
 广州泰和肿瘤医院
广州
广州泰和肿瘤医院
广州
 云南省肿瘤医院
昆明
云南省肿瘤医院
昆明
 北京胸科医院
北京
北京胸科医院
北京
第100名 综合排名
 中山大学附属第五医院
珠海
中山大学附属第五医院
珠海
 哈尔滨医科大学附属肿瘤医院
哈尔滨
哈尔滨医科大学附属肿瘤医院
哈尔滨
 北京大学人民医院
北京
北京大学人民医院
北京
第21名 综合排名
 上海市质子重离子医院
上海
上海市质子重离子医院
上海
 西安交通大学第一附属医院
西安
西安交通大学第一附属医院
西安
第63名 综合排名
 中国科学技术大学附属第一医院
合肥
中国科学技术大学附属第一医院
合肥
第95名 综合排名
 山东大学齐鲁医院
济南
山东大学齐鲁医院
济南
第24名 综合排名
 吉林省肿瘤医院
长春
吉林省肿瘤医院
长春
 辽宁省肿瘤医院
沈阳
辽宁省肿瘤医院
沈阳
 浙江大学医学院附属妇产科医院
杭州
浙江大学医学院附属妇产科医院
杭州
第91名 综合排名
 北部战区总医院
沈阳
北部战区总医院
沈阳
 深圳市第三人民医院
深圳
深圳市第三人民医院
深圳
 山西省肿瘤医院
太原
山西省肿瘤医院
太原
 杭州市肿瘤医院
杭州
杭州市肿瘤医院
杭州
 南京市胸科医院
南京
南京市胸科医院
南京
 中日友好医院
北京
中日友好医院
北京
第43名 综合排名
 福建省肿瘤医院
福州
福建省肿瘤医院
福州
 广东省人民医院
广州
广东省人民医院
广州
第34名 综合排名
 四川省肿瘤医院
成都
四川省肿瘤医院
成都
 中山大学附属第三医院
广州
中山大学附属第三医院
广州
第45名 综合排名
 上海美中嘉和肿瘤门诊部
上海
上海美中嘉和肿瘤门诊部
上海
 中山大学附属第六医院
广州
中山大学附属第六医院
广州
 西南医院
重庆
西南医院
重庆
 新桥医院
重庆
新桥医院
重庆
 福建医科大学附属第一医院
福州
福建医科大学附属第一医院
福州
第84名 综合排名
 兰州大学第二医院
兰州
兰州大学第二医院
兰州
 广东省中医院
广州
广东省中医院
广州
 山东省立医院
济南
山东省立医院
济南
第52名 综合排名
 武汉大学中南医院
武汉
武汉大学中南医院
武汉
第55名 综合排名
 上海长征医院
上海
上海长征医院
上海
 厦门大学附属第一医院
厦门
厦门大学附属第一医院
厦门
 南京鼓楼医院
南京
南京鼓楼医院
南京
 中国科大附一院
安徽
中国科大附一院
安徽
 山东省公共卫生临床中心
济南
山东省公共卫生临床中心
济南
 重庆医科大学附属第一医院
重庆
重庆医科大学附属第一医院
重庆
第48名 综合排名
 中南大学湘雅二医院
长沙
中南大学湘雅二医院
长沙
第20名 综合排名
 四川省人民医院
成都
四川省人民医院
成都
第38名 综合排名
 吉林大学白求恩第一医院
长春
吉林大学白求恩第一医院
长春
 东部战区总医院
南京
东部战区总医院
南京
第58名 综合排名
 中山大学孙逸仙纪念医院
广州
中山大学孙逸仙纪念医院
广州
第64名 综合排名
 哈尔滨医科大学附属第一医院
哈尔滨
哈尔滨医科大学附属第一医院
哈尔滨
第78名 综合排名
 上海市肺科医院
上海
上海市肺科医院
上海
第42名 综合排名
 东南大学附属中大医院
南京
东南大学附属中大医院
南京
第46名 综合排名
 哈尔滨医科大学附属第二医院
哈尔滨
哈尔滨医科大学附属第二医院
哈尔滨
第67名 综合排名
 福建医科大学附属协和医院
福州
福建医科大学附属协和医院
福州
第88名 综合排名
 广州医科大学附属第一医院
广州
广州医科大学附属第一医院
广州
第31名 综合排名
 301医院
北京
301医院
北京
 复旦大学附属妇产科医院
上海
复旦大学附属妇产科医院
上海
第85名 综合排名
 重庆大学附属肿瘤医院
重庆
重庆大学附属肿瘤医院
重庆
 中山大学附属肿瘤医院
广州
中山大学附属肿瘤医院
广州
 上海市第十人民医院
上海
上海市第十人民医院
上海
 中南大学湘雅医院
长沙
中南大学湘雅医院
长沙
第15名 综合排名
 复旦大学附属中山医院
上海
复旦大学附属中山医院
上海
第5名 综合排名
 华中科技大学同济医院
武汉
华中科技大学同济医院
武汉
 北京医院
北京
北京医院
北京
第60名 综合排名
 上海交通大学医学院附属仁济医院
上海
上海交通大学医学院附属仁济医院
上海
第17名 综合排名
 浙江省肿瘤医院
杭州
浙江省肿瘤医院
杭州
第8名 肿瘤科排名
 北京京西肿瘤医院
北京
北京京西肿瘤医院
北京
 上海市胸科医院
上海
上海市胸科医院
上海
第80名 综合排名
 湖南省肿瘤医院
长沙
湖南省肿瘤医院
长沙
 上海新华医院
上海
上海新华医院
上海
 江苏省肿瘤医院
南京
江苏省肿瘤医院
南京
第9名 肿瘤科排名
 中山大学附属第一医院
广州
中山大学附属第一医院
广州
第9名 综合排名
 南方医科大学南方医院
广州
南方医科大学南方医院
广州
第18名 综合排名
 上海市东方医院
上海
上海市东方医院
上海
 浙大二院
杭州
浙大二院
杭州
 浙江大学医学院附属第一医院
杭州
浙江大学医学院附属第一医院
杭州
第10名 综合排名
 湖北省肿瘤医院
武汉
湖北省肿瘤医院
武汉
 北京大学第一医院
北京
北京大学第一医院
北京
第12名 综合排名
 河南省肿瘤医院
郑州
河南省肿瘤医院
郑州
 苏州大学附属第一医院
苏州
苏州大学附属第一医院
苏州
第54名 综合排名
 武汉大学人民医院
武汉
武汉大学人民医院
武汉
第40名 综合排名
 中国医科大学附属盛京医院
沈阳
中国医科大学附属盛京医院
沈阳
第33名 综合排名
 上海长海医院
上海
上海长海医院
上海
 上海东方肝胆外科医院
上海
上海东方肝胆外科医院
上海
 浙江大学医学院附属邵逸夫医院
杭州
浙江大学医学院附属邵逸夫医院
杭州
第49名 综合排名
 复旦大学附属华山医院
上海
复旦大学附属华山医院
上海
第8名 综合排名
 广州泰和肿瘤医院
广州
广州泰和肿瘤医院
广州
 云南省肿瘤医院
昆明
云南省肿瘤医院
昆明
 北京胸科医院
北京
北京胸科医院
北京
第100名 综合排名
 中山大学附属第五医院
珠海
中山大学附属第五医院
珠海
 哈尔滨医科大学附属肿瘤医院
哈尔滨
哈尔滨医科大学附属肿瘤医院
哈尔滨
 北京大学人民医院
北京
北京大学人民医院
北京
第21名 综合排名
 上海市质子重离子医院
上海
上海市质子重离子医院
上海
 西安交通大学第一附属医院
西安
西安交通大学第一附属医院
西安
第63名 综合排名
 中国科学技术大学附属第一医院
合肥
中国科学技术大学附属第一医院
合肥
第95名 综合排名
 山东大学齐鲁医院
济南
山东大学齐鲁医院
济南
第24名 综合排名
 辽宁省肿瘤医院
沈阳
辽宁省肿瘤医院
沈阳
 山西省肿瘤医院
太原
山西省肿瘤医院
太原
 新桥医院
重庆
新桥医院
重庆
 浙江大学医学院附属妇产科医院
杭州
浙江大学医学院附属妇产科医院
杭州
第91名 综合排名
 北部战区总医院
沈阳
北部战区总医院
沈阳
 深圳市第三人民医院
深圳
深圳市第三人民医院
深圳
 吉林省肿瘤医院
长春
吉林省肿瘤医院
长春
 杭州市肿瘤医院
杭州
杭州市肿瘤医院
杭州
 中山大学附属第三医院
广州
中山大学附属第三医院
广州
第45名 综合排名
 中日友好医院
北京
中日友好医院
北京
第43名 综合排名
 福建省肿瘤医院
福州
福建省肿瘤医院
福州
 广东省人民医院
广州
广东省人民医院
广州
第34名 综合排名
 上海美中嘉和肿瘤门诊部
上海
上海美中嘉和肿瘤门诊部
上海
 西南医院
重庆
西南医院
重庆
 南京市胸科医院
南京
南京市胸科医院
南京
 中山大学附属第六医院
广州
中山大学附属第六医院
广州
 福建医科大学附属第一医院
福州
福建医科大学附属第一医院
福州
第84名 综合排名
 哈尔滨医科大学附属第一医院
哈尔滨
哈尔滨医科大学附属第一医院
哈尔滨
第78名 综合排名
 兰州大学第二医院
兰州
兰州大学第二医院
兰州
 广东省中医院
广州
广东省中医院
广州
 山东省立医院
济南
山东省立医院
济南
第52名 综合排名
 上海长征医院
上海
上海长征医院
上海
 厦门大学附属第一医院
厦门
厦门大学附属第一医院
厦门
 南京鼓楼医院
南京
南京鼓楼医院
南京
 中国科大附一院
安徽
中国科大附一院
安徽
 山东省公共卫生临床中心
济南
山东省公共卫生临床中心
济南
 重庆医科大学附属第一医院
重庆
重庆医科大学附属第一医院
重庆
第48名 综合排名
 武汉大学中南医院
武汉
武汉大学中南医院
武汉
第55名 综合排名
 中南大学湘雅二医院
长沙
中南大学湘雅二医院
长沙
第20名 综合排名
 上海市肺科医院
上海
上海市肺科医院
上海
第42名 综合排名
 吉林大学白求恩第一医院
长春
吉林大学白求恩第一医院
长春
 东部战区总医院
南京
东部战区总医院
南京
第58名 综合排名
 中山大学孙逸仙纪念医院
广州
中山大学孙逸仙纪念医院
广州
第64名 综合排名
 东南大学附属中大医院
南京
东南大学附属中大医院
南京
第46名 综合排名
 301医院
北京
301医院
北京
 四川省人民医院
成都
四川省人民医院
成都
第38名 综合排名
 哈尔滨医科大学附属第二医院
哈尔滨
哈尔滨医科大学附属第二医院
哈尔滨
第67名 综合排名
 广州医科大学附属第一医院
广州
广州医科大学附属第一医院
广州
第31名 综合排名
 四川省肿瘤医院
成都
四川省肿瘤医院
成都
 复旦大学附属妇产科医院
上海
复旦大学附属妇产科医院
上海
第85名 综合排名
 重庆大学附属肿瘤医院
重庆
重庆大学附属肿瘤医院
重庆
 中山大学附属肿瘤医院
广州
中山大学附属肿瘤医院
广州
 上海市第十人民医院
上海
上海市第十人民医院
上海
 中南大学湘雅医院
长沙
中南大学湘雅医院
长沙
第15名 综合排名
 复旦大学附属中山医院
上海
复旦大学附属中山医院
上海
第5名 综合排名
 华中科技大学同济医院
武汉
华中科技大学同济医院
武汉
 北京医院
北京
北京医院
北京
第60名 综合排名
 上海交通大学医学院附属仁济医院
上海
上海交通大学医学院附属仁济医院
上海
第17名 综合排名
 浙江省肿瘤医院
杭州
浙江省肿瘤医院
杭州
第8名 肿瘤科排名
 北京京西肿瘤医院
北京
北京京西肿瘤医院
北京
 上海交通大学医学院附属瑞金医院
上海
上海交通大学医学院附属瑞金医院
上海
第4名 综合排名
 上海市胸科医院
上海
上海市胸科医院
上海
第80名 综合排名
 湖南省肿瘤医院
长沙
湖南省肿瘤医院
长沙
 上海新华医院
上海
上海新华医院
上海
 江苏省肿瘤医院
南京
江苏省肿瘤医院
南京
第9名 肿瘤科排名
 中山大学附属第一医院
广州
中山大学附属第一医院
广州
第9名 综合排名
 南方医科大学南方医院
广州
南方医科大学南方医院
广州
第18名 综合排名
 上海市东方医院
上海
上海市东方医院
上海
 北京大学第一医院
北京
北京大学第一医院
北京
第12名 综合排名
 浙大二院
杭州
浙大二院
杭州
 浙江大学医学院附属第一医院
杭州
浙江大学医学院附属第一医院
杭州
第10名 综合排名
 河南省肿瘤医院
郑州
河南省肿瘤医院
郑州
 武汉大学人民医院
武汉
武汉大学人民医院
武汉
第40名 综合排名
 湖北省肿瘤医院
武汉
湖北省肿瘤医院
武汉
 上海东方肝胆外科医院
上海
上海东方肝胆外科医院
上海
 浙江大学医学院附属邵逸夫医院
杭州
浙江大学医学院附属邵逸夫医院
杭州
第49名 综合排名
 复旦大学附属华山医院
上海
复旦大学附属华山医院
上海
第8名 综合排名
 广州泰和肿瘤医院
广州
广州泰和肿瘤医院
广州
 云南省肿瘤医院
昆明
云南省肿瘤医院
昆明
 北京胸科医院
北京
北京胸科医院
北京
第100名 综合排名
 上海长海医院
上海
上海长海医院
上海
 中山大学附属第五医院
珠海
中山大学附属第五医院
珠海
 哈尔滨医科大学附属肿瘤医院
哈尔滨
哈尔滨医科大学附属肿瘤医院
哈尔滨
 北京大学人民医院
北京
北京大学人民医院
北京
第21名 综合排名
 上海市质子重离子医院
上海
上海市质子重离子医院
上海
 中国科学技术大学附属第一医院
合肥
中国科学技术大学附属第一医院
合肥
第95名 综合排名
 山东大学齐鲁医院
济南
山东大学齐鲁医院
济南
第24名 综合排名
 吉林省肿瘤医院
长春
吉林省肿瘤医院
长春
 山西省肿瘤医院
太原
山西省肿瘤医院
太原
 新桥医院
重庆
新桥医院
重庆
 浙江大学医学院附属妇产科医院
杭州
浙江大学医学院附属妇产科医院
杭州
第91名 综合排名
 北部战区总医院
沈阳
北部战区总医院
沈阳
 深圳市第三人民医院
深圳
深圳市第三人民医院
深圳
 杭州市肿瘤医院
杭州
杭州市肿瘤医院
杭州
 南京市胸科医院
南京
南京市胸科医院
南京
 中日友好医院
北京
中日友好医院
北京
第43名 综合排名
 福建省肿瘤医院
福州
福建省肿瘤医院
福州
 广东省人民医院
广州
广东省人民医院
广州
第34名 综合排名
 四川省肿瘤医院
成都
四川省肿瘤医院
成都
 中山大学附属第三医院
广州
中山大学附属第三医院
广州
第45名 综合排名
 上海美中嘉和肿瘤门诊部
上海
上海美中嘉和肿瘤门诊部
上海
 中山大学附属第六医院
广州
中山大学附属第六医院
广州
 哈尔滨医科大学附属第一医院
哈尔滨
哈尔滨医科大学附属第一医院
哈尔滨
第78名 综合排名
 四川大学华西第二医院
成都
四川大学华西第二医院
成都
第70名 综合排名
 广东省中医院
广州
广东省中医院
广州
 上海长征医院
上海
上海长征医院
上海
 厦门大学附属第一医院
厦门
厦门大学附属第一医院
厦门
 南京鼓楼医院
南京
南京鼓楼医院
南京
 中国科大附一院
安徽
中国科大附一院
安徽
 山东省公共卫生临床中心
济南
山东省公共卫生临床中心
济南
 武汉大学中南医院
武汉
武汉大学中南医院
武汉
第55名 综合排名
 中南大学湘雅二医院
长沙
中南大学湘雅二医院
长沙
第20名 综合排名
 上海市肺科医院
上海
上海市肺科医院
上海
第42名 综合排名
 吉林大学白求恩第一医院
长春
吉林大学白求恩第一医院
长春
 哈尔滨医科大学附属第二医院
哈尔滨
哈尔滨医科大学附属第二医院
哈尔滨
第67名 综合排名
 广州医科大学附属第一医院
广州
广州医科大学附属第一医院
广州
第31名 综合排名
 复旦大学附属妇产科医院
上海
复旦大学附属妇产科医院
上海
第85名 综合排名
 重庆大学附属肿瘤医院
重庆
重庆大学附属肿瘤医院
重庆
 中山大学附属肿瘤医院
广州
中山大学附属肿瘤医院
广州
 上海市第十人民医院
上海
上海市第十人民医院
上海
 中南大学湘雅医院
长沙
中南大学湘雅医院
长沙
第15名 综合排名
 复旦大学附属中山医院
上海
复旦大学附属中山医院
上海
第5名 综合排名
 华中科技大学同济医院
武汉
华中科技大学同济医院
武汉
 北京医院
北京
北京医院
北京
第60名 综合排名
 上海交通大学医学院附属仁济医院
上海
上海交通大学医学院附属仁济医院
上海
第17名 综合排名
 浙江省肿瘤医院
杭州
浙江省肿瘤医院
杭州
第8名 肿瘤科排名
 北京京西肿瘤医院
北京
北京京西肿瘤医院
北京
 上海交通大学医学院附属瑞金医院
上海
上海交通大学医学院附属瑞金医院
上海
第4名 综合排名
 上海市胸科医院
上海
上海市胸科医院
上海
第80名 综合排名
 湖南省肿瘤医院
长沙
湖南省肿瘤医院
长沙
 江苏省肿瘤医院
南京
江苏省肿瘤医院
南京
第9名 肿瘤科排名
 中山大学附属第一医院
广州
中山大学附属第一医院
广州
第9名 综合排名
 南方医科大学南方医院
广州
南方医科大学南方医院
广州
第18名 综合排名
 上海市东方医院
上海
上海市东方医院
上海
 湖北省肿瘤医院
武汉
湖北省肿瘤医院
武汉
 北京大学第一医院
北京
北京大学第一医院
北京
第12名 综合排名
 河南省肿瘤医院
郑州
河南省肿瘤医院
郑州
 苏州大学附属第一医院
苏州
苏州大学附属第一医院
苏州
第54名 综合排名
 武汉大学人民医院
武汉
武汉大学人民医院
武汉
第40名 综合排名
 中国医科大学附属盛京医院
沈阳
中国医科大学附属盛京医院
沈阳
第33名 综合排名
 中国医科大学附属第一医院
沈阳
中国医科大学附属第一医院
沈阳
第16名 综合排名
 上海东方肝胆外科医院
上海
上海东方肝胆外科医院
上海
 复旦大学附属华山医院
上海
复旦大学附属华山医院
上海
第8名 综合排名
 广州泰和肿瘤医院
广州
广州泰和肿瘤医院
广州
 云南省肿瘤医院
昆明
云南省肿瘤医院
昆明
 北京胸科医院
北京
北京胸科医院
北京
第100名 综合排名
 上海长海医院
上海
上海长海医院
上海
 中山大学附属第五医院
珠海
中山大学附属第五医院
珠海
 哈尔滨医科大学附属肿瘤医院
哈尔滨
哈尔滨医科大学附属肿瘤医院
哈尔滨
 北京大学人民医院
北京
北京大学人民医院
北京
第21名 综合排名
 上海市质子重离子医院
上海
上海市质子重离子医院
上海
 西安交通大学第一附属医院
西安
西安交通大学第一附属医院
西安
第63名 综合排名
 中国科学技术大学附属第一医院
合肥
中国科学技术大学附属第一医院
合肥
第95名 综合排名
 山东大学齐鲁医院
济南
山东大学齐鲁医院
济南
第24名 综合排名
 吉林省肿瘤医院
长春
吉林省肿瘤医院
长春
 辽宁省肿瘤医院
沈阳
辽宁省肿瘤医院
沈阳
 山西省肿瘤医院
太原
山西省肿瘤医院
太原
 新桥医院
重庆
新桥医院
重庆
 浙江大学医学院附属妇产科医院
杭州
浙江大学医学院附属妇产科医院
杭州
第91名 综合排名
 北部战区总医院
沈阳
北部战区总医院
沈阳
 深圳市第三人民医院
深圳
深圳市第三人民医院
深圳
 杭州市肿瘤医院
杭州
杭州市肿瘤医院
杭州
 南京市胸科医院
南京
南京市胸科医院
南京
 中日友好医院
北京
中日友好医院
北京
第43名 综合排名
 福建省肿瘤医院
福州
福建省肿瘤医院
福州
 广东省人民医院
广州
广东省人民医院
广州
第34名 综合排名
 四川省肿瘤医院
成都
四川省肿瘤医院
成都
 中山大学附属第三医院
广州
中山大学附属第三医院
广州
第45名 综合排名
 上海美中嘉和肿瘤门诊部
上海
上海美中嘉和肿瘤门诊部
上海
 中山大学附属第六医院
广州
中山大学附属第六医院
广州
 西南医院
重庆
西南医院
重庆
 福建医科大学附属第一医院
福州
福建医科大学附属第一医院
福州
第84名 综合排名
 哈尔滨医科大学附属第一医院
哈尔滨
哈尔滨医科大学附属第一医院
哈尔滨
第78名 综合排名
 兰州大学第二医院
兰州
兰州大学第二医院
兰州
 四川大学华西第二医院
成都
四川大学华西第二医院
成都
第70名 综合排名
 广东省中医院
广州
广东省中医院
广州
 山东省立医院
济南
山东省立医院
济南
第52名 综合排名
 上海长征医院
上海
上海长征医院
上海
 厦门大学附属第一医院
厦门
厦门大学附属第一医院
厦门
 南京鼓楼医院
南京
南京鼓楼医院
南京
 中国科大附一院
安徽
中国科大附一院
安徽
 山东省公共卫生临床中心
济南
山东省公共卫生临床中心
济南
 重庆医科大学附属第一医院
重庆
重庆医科大学附属第一医院
重庆
第48名 综合排名
 武汉大学中南医院
武汉
武汉大学中南医院
武汉
第55名 综合排名
 中南大学湘雅二医院
长沙
中南大学湘雅二医院
长沙
第20名 综合排名
 上海市肺科医院
上海
上海市肺科医院
上海
第42名 综合排名
 吉林大学白求恩第一医院
长春
吉林大学白求恩第一医院
长春
 东部战区总医院
南京
东部战区总医院
南京
第58名 综合排名
 中山大学孙逸仙纪念医院
广州
中山大学孙逸仙纪念医院
广州
第64名 综合排名
 东南大学附属中大医院
南京
东南大学附属中大医院
南京
第46名 综合排名
 301医院
北京
301医院
北京
 四川省人民医院
成都
四川省人民医院
成都
第38名 综合排名
 哈尔滨医科大学附属第二医院
哈尔滨
哈尔滨医科大学附属第二医院
哈尔滨
第67名 综合排名
 福建医科大学附属协和医院
福州
福建医科大学附属协和医院
福州
第88名 综合排名
 广州医科大学附属第一医院
广州
广州医科大学附属第一医院
广州
第31名 综合排名
 复旦大学附属妇产科医院
上海
复旦大学附属妇产科医院
上海
第85名 综合排名
 重庆大学附属肿瘤医院
重庆
重庆大学附属肿瘤医院
重庆
 中山大学附属肿瘤医院
广州
中山大学附属肿瘤医院
广州
 上海市第十人民医院
上海
上海市第十人民医院
上海
 中南大学湘雅医院
长沙
中南大学湘雅医院
长沙
第15名 综合排名
 复旦大学附属中山医院
上海
复旦大学附属中山医院
上海
第5名 综合排名
 华中科技大学同济医院
武汉
华中科技大学同济医院
武汉
 北京医院
北京
北京医院
北京
第60名 综合排名
 上海交通大学医学院附属仁济医院
上海
上海交通大学医学院附属仁济医院
上海
第17名 综合排名
 浙江省肿瘤医院
杭州
浙江省肿瘤医院
杭州
第8名 肿瘤科排名
 北京京西肿瘤医院
北京
北京京西肿瘤医院
北京
 上海交通大学医学院附属瑞金医院
上海
上海交通大学医学院附属瑞金医院
上海
第4名 综合排名
 上海市胸科医院
上海
上海市胸科医院
上海
第80名 综合排名
 湖南省肿瘤医院
长沙
湖南省肿瘤医院
长沙
 上海新华医院
上海
上海新华医院
上海
 江苏省肿瘤医院
南京
江苏省肿瘤医院
南京
第9名 肿瘤科排名
 中山大学附属第一医院
广州
中山大学附属第一医院
广州
第9名 综合排名
 南方医科大学南方医院
广州
南方医科大学南方医院
广州
第18名 综合排名
 上海市东方医院
上海
上海市东方医院
上海
 浙大二院
杭州
浙大二院
杭州
 浙江大学医学院附属第一医院
杭州
浙江大学医学院附属第一医院
杭州
第10名 综合排名
 湖北省肿瘤医院
武汉
湖北省肿瘤医院
武汉
 北京大学第一医院
北京
北京大学第一医院
北京
第12名 综合排名
 河南省肿瘤医院
郑州
河南省肿瘤医院
郑州
 苏州大学附属第一医院
苏州
苏州大学附属第一医院
苏州
第54名 综合排名
 武汉大学人民医院
武汉
武汉大学人民医院
武汉
第40名 综合排名
 中国医科大学附属盛京医院
沈阳
中国医科大学附属盛京医院
沈阳
第33名 综合排名
 中国医科大学附属第一医院
沈阳
中国医科大学附属第一医院
沈阳
第16名 综合排名
 上海东方肝胆外科医院
上海
上海东方肝胆外科医院
上海
 浙江大学医学院附属邵逸夫医院
杭州
浙江大学医学院附属邵逸夫医院
杭州
第49名 综合排名
 复旦大学附属华山医院
上海
复旦大学附属华山医院
上海
第8名 综合排名
 广州泰和肿瘤医院
广州
广州泰和肿瘤医院
广州
 云南省肿瘤医院
昆明
云南省肿瘤医院
昆明
 北京胸科医院
北京
北京胸科医院
北京
第100名 综合排名
 上海长海医院
上海
上海长海医院
上海
 中山大学附属第五医院
珠海
中山大学附属第五医院
珠海
 哈尔滨医科大学附属肿瘤医院
哈尔滨
哈尔滨医科大学附属肿瘤医院
哈尔滨
 北京大学人民医院
北京
北京大学人民医院
北京
第21名 综合排名
 上海市质子重离子医院
上海
上海市质子重离子医院
上海
 帕博利珠单抗在美国获批新适应症:用于联合化疗一线治疗HER2阴性胃...
帕博利珠单抗在美国获批新适应症:用于联合化疗一线治疗HER2阴性胃...
 康方生物卡度尼利获《基于PD-L1蛋白表达水平的胃癌免疫治疗专家...
康方生物卡度尼利获《基于PD-L1蛋白表达水平的胃癌免疫治疗专家...
 辉瑞择捷美第五个适应症获批,成为首个治疗胃癌的PD-L1抑制剂...
辉瑞择捷美第五个适应症获批,成为首个治疗胃癌的PD-L1抑制剂...
 安斯泰来 VYLOY (zolbetuximab)在日本获批用于治疗胃癌...
安斯泰来 VYLOY (zolbetuximab)在日本获批用于治疗胃癌...
 卡度尼利单抗获批胃癌!PD-1单抗遇挫下,及时到来的新「解」...
卡度尼利单抗获批胃癌!PD-1单抗遇挫下,及时到来的新「解」...
 FDA 批准默克公司的 Keytruda (帕博利珠单抗) 用于表达 PD-L1复...
FDA 批准默克公司的 Keytruda (帕博利珠单抗) 用于表达 PD-L1复...
 ATTRACTION-5研究-纳武利尤单抗联合化疗术后辅助治疗III期胃或胃...
ATTRACTION-5研究-纳武利尤单抗联合化疗术后辅助治疗III期胃或胃...
 胃癌二线治疗新选择:阿帕替尼联合伊立替康作为胃腺癌或胃食管结合...
胃癌二线治疗新选择:阿帕替尼联合伊立替康作为胃腺癌或胃食管结合...
 胃癌治疗终于取得重大突破!哪些中国患者能获益?...
胃癌治疗终于取得重大突破!哪些中国患者能获益?...
 转换用药,安全有效 | 一例赫赛汀?转换为汉曲优?治疗HER2阳性晚期...
转换用药,安全有效 | 一例赫赛汀?转换为汉曲优?治疗HER2阳性晚期...
 T-DXd助力HER2阳性IV期胃癌患者获得二次转化手术机会,无疾病进展...
T-DXd助力HER2阳性IV期胃癌患者获得二次转化手术机会,无疾病进展...
 一例汉曲优联合化疗治疗HER2阳性胃癌肝转移的病例分享...
一例汉曲优联合化疗治疗HER2阳性胃癌肝转移的病例分享...
搜索结果
胃癌药物分类
 胃肠道间质瘤介绍
胃肠道间质瘤介绍
 胃肠“隐形杀手”!关注胃肠间质瘤,一起守“胃”健康!...
胃肠“隐形杀手”!关注胃肠间质瘤,一起守“胃”健康!...
 胃肠道间质瘤的症状及治疗
胃肠道间质瘤的症状及治疗
 小胃肠间质瘤诊疗中国专家共识(2020年版)
小胃肠间质瘤诊疗中国专家共识(2020年版)
 破除恐惧 科学治疗胃肠间质瘤
破除恐惧 科学治疗胃肠间质瘤
 疾病知识 I 科学战“瘤”记
疾病知识 I 科学战“瘤”记
 早期胃癌能治好吗?生存率是多少?
早期胃癌能治好吗?生存率是多少?
 得了胃癌是不是没救了?
得了胃癌是不是没救了?
 如果不幸得了胃癌,该怎么办?
如果不幸得了胃癌,该怎么办?
 一病一专科 | 胃肿瘤:仁济护航,无所“胃”惧!做人生的主角!...
一病一专科 | 胃肿瘤:仁济护航,无所“胃”惧!做人生的主角!...
其他热门专题
 中位生存期不足5个月? 胃癌腹膜转移介绍
中位生存期不足5个月? 胃癌腹膜转移介绍
 胃癌腹膜转移,晚期中晚期,还有哪些治疗方案?...
胃癌腹膜转移,晚期中晚期,还有哪些治疗方案?...
 什么是腹腔港?看腹腔港在胃癌腹膜转移治疗中如何应用...
什么是腹腔港?看腹腔港在胃癌腹膜转移治疗中如何应用...
 年轻女性盆腔炎久治未愈,检查后发现竟是胃癌晚期转移!...
年轻女性盆腔炎久治未愈,检查后发现竟是胃癌晚期转移!...
 难以忍受的“脑壳疼”,竟然是胃癌转移
难以忍受的“脑壳疼”,竟然是胃癌转移
 不痛不痒的“脖子瘤”,竟然是胃癌转移到了淋巴结?...
不痛不痒的“脖子瘤”,竟然是胃癌转移到了淋巴结?...
 胃癌出现淋巴结转移就是晚期吗?
胃癌出现淋巴结转移就是晚期吗?
 胃癌患者检查发现有转移了,还有得救吗?
胃癌患者检查发现有转移了,还有得救吗?
 胃癌患者术后会复发吗?肿瘤标志物指标升高提示复发吗?...
胃癌患者术后会复发吗?肿瘤标志物指标升高提示复发吗?...
 胃癌肝转移的肝脏手术治疗
胃癌肝转移的肝脏手术治疗
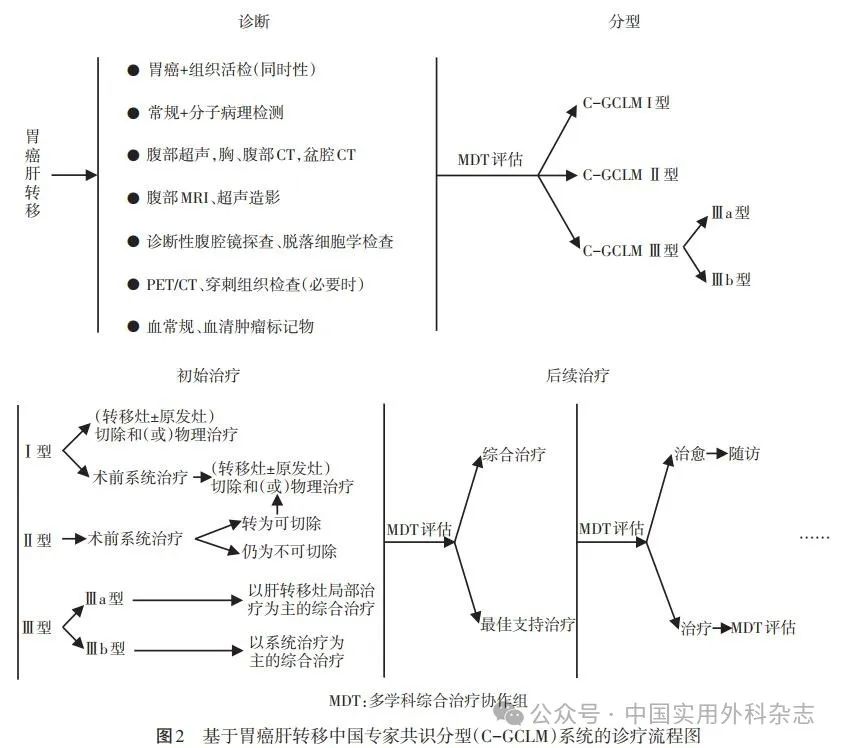 胃癌肝转移诊断与综合治疗中国专家共识
胃癌肝转移诊断与综合治疗中国专家共识
 发现胃癌肝转移了怎么办?
发现胃癌肝转移了怎么办?
其他热门专题
 东亚人喝酒更容易得胃癌?喝酒上脸的注意了
东亚人喝酒更容易得胃癌?喝酒上脸的注意了
 喝酒不吃饭,胃癌风险涨一半!34万人10年随访显示,空腹喝酒与胃肠道癌...
喝酒不吃饭,胃癌风险涨一半!34万人10年随访显示,空腹喝酒与胃肠道癌...
 Science子刊:东亚人喝酒更容易得胃癌?喝酒上脸的注意了...
Science子刊:东亚人喝酒更容易得胃癌?喝酒上脸的注意了...
 萎缩性胃炎专辑:萎缩性胃炎防癌变,补充硒、叶酸很重要!...
萎缩性胃炎专辑:萎缩性胃炎防癌变,补充硒、叶酸很重要!...
 萎缩性胃炎伴肠化,吃叶酸管用吗?
萎缩性胃炎伴肠化,吃叶酸管用吗?
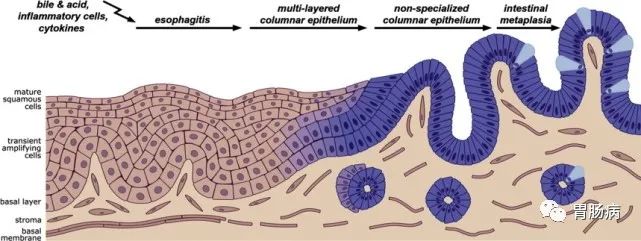 萎缩性胃炎伴肠化,至少1/3可以逆转!
萎缩性胃炎伴肠化,至少1/3可以逆转!
 导致胃癌的病因究竟有哪些?
导致胃癌的病因究竟有哪些?
 续接诊三位胃癌患者,他们都爱吃这种“菜”,大大增加患癌风险!...
续接诊三位胃癌患者,他们都爱吃这种“菜”,大大增加患癌风险!...
 中山胃视|我的家人得了胃癌,作为家属也会得吗?...
中山胃视|我的家人得了胃癌,作为家属也会得吗?...
 多吃葱蒜,能防胃癌?
多吃葱蒜,能防胃癌?
 吃大蒜可防治胃癌!北大长达22年研究显示,长年吃大蒜,胃癌死亡风险降...
吃大蒜可防治胃癌!北大长达22年研究显示,长年吃大蒜,胃癌死亡风险降...
其他热门专题








